| Kierownik projektu: mgr Agata Perlińska | Okres: 2019 - 2021 |
| Finansowanie: PRELUDIUM 15, NCN | |
| Opis: Celem mojego projektu jest zbadanie skomplikowanych białek, które posiadają węzeł w swojej strukturze (Rys. 1). Ten typ białek został po raz pierwszy zaobserwowany ponad 20 lat temu, a dziś białkowe bazy danych zawierają ponad tysiąc znanych zawęźlonych struktur z różnym rodzajem zawęźlenia. Białka zawęźlone tworzą nową i ekscytującą dziedzinę nauki, która łączy w sobie wiele dyscyplin, od biologii, poprzez biochemię, biofizykę, aż po matematykę. W codziennym życiu często używamy węzłów do stabilizacji i naturalnie oczekiwalibyśmy by węzły pojawiały się w białkach o funkcji strukturalnej. Jednakże większość z nich znajdujemy w enzymach. Pojawiają się więc pytania: czy zawęźlony region pomaga białku w katalizowaniu reakcji chemicznej? Czy ma on określoną funkcję do spełnienia? Zwłaszcza, że istnieje białko niezawęźlone, które może pełnić taką samą funkcję (przy użyciu innego mechanizmu).
Ten projekt ma na celu przybliżenie się do odpowiedzi na te, fundamentalne dla biologii strukturalnej, pytania poprzez zrozumienie mechanizmu funkcjonowania zawęźlonego białka oraz roli jaką pełni w nim węzeł. Projekt skupia się na analizie białek odpowiedzialnych za metylację kwasów nukleinowych. W szczególności, na bakteryjnej metylotransferazie TrmD – białku z najprostszym i najczęściej spotykanym typem węzła (powiększenie na Rys. 1). Aktywność TrmD zależy od stężenia magnezu w komórce – jon Mg2+ jest konieczny do efektywnej katalizy. To niezbędne do życia białko składa się z dwóch identycznych podjednostek, a więc i dwóch identycznych miejsc aktywnych. Jednakże, w danym momencie reakcja zachodzi tylko w jednym z nich. Taki mechanizm funkcjonowania białka może być powiązany z regionem węzłowym, który tworzy kieszeń wiążącą dla ligandu. Analiza dostępnych struktur krystalicznych różnych kompleksów TrmD nie wyjaśnia jednak jego działania – kompleks w krysztale nie jest asymetryczny, nieobecne są również jony magnezu. Krystalizacja dostarcza jednak jedynie statyczny obraz struktury, zatem odpowiedź musi leżeć w dynamice białka, która jest trudna do uchwycenia drogą eksperymentalną. Z tego powodu głównym celem mojego projektu jest zbadanie i scharakteryzowanie, przy użyciu metod teoretycznych, odpowiednich warunków i zachowania zawęźlonego białka, które prowadzą do jego aktywacji.
Mój pomysł na rozwiązanie zagadki roli węzła obejmuje podejście łączące symulacje dynamiki molekularnej oraz obliczenia kwantowo-chemiczne wsparte wynikami przeprowadzonych eksperymentów. Przeprowadzę wiele symulacji, które pokażą zachowanie białka w wodzie (w warunkach zbliżonych do naturalnie występujących w komórce) z dokładnością co do atomu. Porównanie symulacji o różnej liczbie ligandów, różniących się strukturą startową, a także warunkami (obecność/brak jonów magnezu) pozwoli mi wyjaśnić co sprawia, że białko przechodzi w stan aktywacji. W szczególności, jak asymetria wpływa na białko i jaka jest jej rola. Ponadto, w jaki sposób magnez zmienia strukturę białka oraz czy jego znaczenie dla katalizy jest powiązane z jego wpływem na asymetrię. Uzyskane odpowiedzi pokażą również, czy zawęźlony region białka jest częścią mechanizmu aktywującego TrmD i jaka jest jego rola. Ostatnim krokiem projektu jest sprawdzenie, czy znalezione cechy występują także w innych białkach zawęźlonych (w szczególności innych metylotransferazach). W szczególności, za pomocą obliczeń kwantowych określę, czy magnez jest ważny dla katalizy transferu metylu w tych białkach, tak jak ma to miejsce w przypadku TrmD. Badanie zawęźlonych białek, w szczególności TrmD, to nie tylko badania podstawowe, ale także krok w kierunku rzeczywistych zastosowań, takich jak tworzenie nowych antybiotyków. Światowa Organizacja Zdrowia opublikowała niedawno listę 12 opornych na leki bakterii, które określono jako patogeny o wysokim priorytecie. TrmD, niezbędne dla życia bakterii białko, obecne we wszystkich tych szczepach, jest zatem doskonałym celem przeciwbakteryjnym do projektowania leków. Z tego powodu wyniki tego projektu dostarczą również informacji niezbędnych do znalezienia silnego antybiotyku. Sukces tego interdyscyplinarnego projektu wymaga specjalistycznej wiedzy z wielu dziedzin. Moja znajomość biologii, bioinformatyki i biofizyki, razem z wieloletnim doświadczeniem mojego opiekuna (dr hab. Joanny Sułkowskiej) nad badaniem białek zawęźlonych, a także współpraca z grupą eksperymentalną kierowaną przez prof. Hou, sprawia, że projekt ten zostanie pomyślnie ukończony. |
|
|
Interdyscyplinarne Laboratorium Modelowania Układów Biologicznych |
|



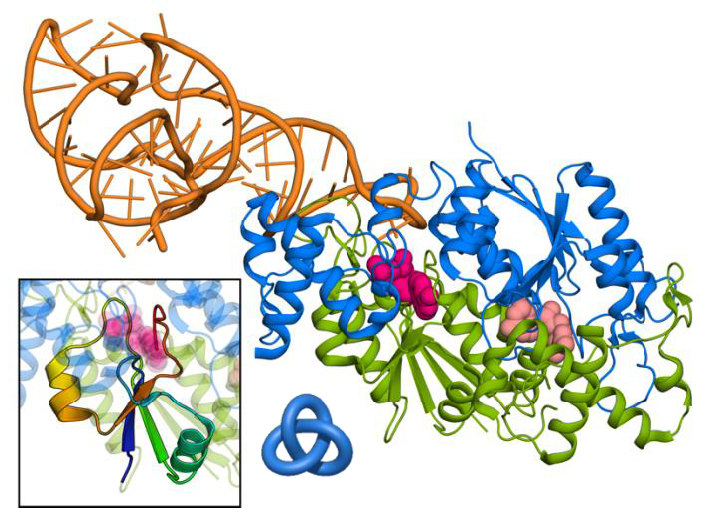 Rysunek 1: Uproszczona reprezentacja białka TrmD (podjednostki oznaczone kolorem niebieskim i zielonym) w kompleksie z tRNA (pomarańczowy) i dwoma ligandami (różowy). Powiększenie pokazuje zawęźlony region białka, obok schemat węzła.
Rysunek 1: Uproszczona reprezentacja białka TrmD (podjednostki oznaczone kolorem niebieskim i zielonym) w kompleksie z tRNA (pomarańczowy) i dwoma ligandami (różowy). Powiększenie pokazuje zawęźlony region białka, obok schemat węzła.