Wszystkie reakcje chemiczne można podzielić w uproszeniu na dwa rodzaje: reakcje kwas-zasada oraz utleniania-redukcji. Te ostatnie nazywane są krótko procesami redoksowymi. Ich główną cechę stanowi fakt przeskoku elektronu lub elektronów pomiędzy reagentami. Reakcje takie wyzwalają często bardzo dużo energii i nie dają się łatwo kontrolować – z reguły zachodzą gwałtownie i wyczerpują reagenty do końca. Używanie do reakcji redoksowych tzw. silnych utleniaczy lub/i silnych reduktorów może się skończyć spektakularnym wybuchem z towarzyszącymi mu efektami świetlnymi, dźwiękowymi, oraz falą uderzeniową. Na przykład, największe konwencjonalne bomby używane przez armię USA zdolne do kruszenia stropów o grubości dziesięciu metrów zawierają tylko dwie substancje: utleniacz saletrę amonową oraz reduktor metaliczny glin. Tymczasem ani saletra amonowa ani glin nie należą wcale do ekstremalnie silnych utleniaczy / reduktorów! By zilustrować potęgę reakcji redoksowych można przywołać przykład reakcji między atomami cezu i atomami fluoru z utworzeniem krystalicznej soli, fluorku cezu. Okazuje się, że nawet gdyby nasz wszechświat, który zawiera (jak się szacuje górną granicę) ok. 1082 atomów, był złożony wyłącznie z równej ilości atomów cezu i fluoru, po reakcji i tak nie pozostałby ani jeden atom cezu i fluoru – reakcja byłaby w sensie dosłownym i matematycznym kompletna. Ponieważ reakcje redoksowe nie są cząstkowe, możemy zapisać odpowiednie równanie reakcji jako:
A + B —> A+ + B–
W reakcji takiej reagenty A i B wymieniły dokładnie jeden elektron.
Kompletność reakcji redoksowych powoduje, że niemal wszystkie znane nauce związki chemiczne możemy sklasyfikować przypisując atomom składowym tzw. formalne stopnie utlenienia. W opisywanym wyżej przykładzie, są to stopień +1 dla cezu i –1 dla fluoru w krystalicznym fluorku cezu. Pozwala to na łatwe sklasyfikowanie związków chemicznych w szczególności zawierających te pierwiastki, które mogą występować na kilku różnych stopniach utlenienia. Klasyfikacja zaś wprowadza porządek w zbiorze kilkunastu milionów znanych związków chemicznych i ułatwia rozumienie i nauczanie chemii.
Istnieje jednak ciekawa, lecz bardzo wąska grupa związków chemicznych, w których pierwiastkowi wchodzącemu w skład związku nie sposób przypisać stopnia utlenienia w postaci liczby całkowitej. Przykładami takich związków są układy domieszkowane tj. takie, w których do prekursora wprowadzono niecałkowitą (w chemii mówimy niestechiometryczną) ilość pewnego dodatku (domieszki). Na przykład, w związku zawierającym cztery pierwiastki, lantan, bar, miedź i tlen, o wzorze chemicznym La2–dBadCuO4, gdzie d może się zmieniać w przedziale od 0 do 1, mówimy, że stopień utlenienia Cu wynosi 2+d tj. zmienia się w sposób ciągły w przedziale od +2 do +3. W tego typu układach wiele właściwości fizykochemicznych w sposób dramatyczny zależy od ilości domieszki, czyli od tzw. stopnia domieszkowania. Na przykład, właściwości elektryczne i magnetyczne La2–dBadCuO4, gdzie d jest stopniem domieszkowania, zmieniają się ekstremalnie silnie w funkcji d:
– dla d=0 związek wykazuje bardzo silne uporządkowanie magnetyczne i jest izolatorem elektryczności;
– dla d=0,05 związek nie wykazuje uporządkowania magnetycznego i nadal jest izolatorem elektryczności;
– dla d=0,35 związek jest metalem tzn. przewodzi dość dobrze prąd elektryczny;
– zaś dla pośredniej wartości d=0,16 związek jest nadprzewodnikiem tzn. przewodzi prąd elektryczny bez żadnego oporu i wykazuje bardzo nietypowe właściwości magnetyczne.
Przykład La2–dBadCuO4 pokazuje, że zmieniając nieznacznie skład chemiczny możemy uzyskać diametralnie różne właściwości. Dlatego związki domieszkowane są chętnie badane przez naukowców i mają olbrzymie znaczenie technologiczne; wytwarzane są z nich rozmaite przydatne człowiekowi urządzenia. Układy takie spowodowały w ciągu ostatnich trzech ćwierci wieku kilka prawdziwych rewolucji cywilizacyjnych:
- domieszkowany krzem, dzięki fabrykowaniu tzw. złączy n/p dał nam radia na tranzystorach, komputery krzemowe, baterie słoneczne i diody LED;
- organiczne polimery przewodzące dostarczyły m.in. powszechnych dziś kolorowych wyświetlaczy i ekranów;
- wspomniany wyżej La2–dBadCuO4 zapoczątkował erę tzw. wysokotemperaturowego nadprzewodnictwa, co prowadzi do obniżenia kosztów za przesyłanie prądu elektrycznego, budowy silnych magnesów dla magnetycznego rezonansu jądrowego oraz konstrukcji lewitujących pociągów, a także do stworzenia ultraszybkich procesorów;
- podobny La1–dCadMnO3 wykazuje tzw. gigantyczną magnetooporność, co ma znaczenie m.in. w różnego typu miernikach i zaworach;
- domieszkowany diament, CBd jest unikatowym materiałem na elektrody;
- LidCoO2 posiada wyjątkową zdolność do gromadzenia litu w szerokim zakresie stężeń i przewodzenia jonów litu przez zdefektowaną sieć krystaliczną co spowodowało dynamiczny rozwój baterii litowych;
Przykłady można by mnożyć dalej.
Nic dziwnego, że za badania takich materiałów oraz wytworzenie urządzeń na ich bazie przyznano już kilka Nagród Nobla.
Mimo ich fascynujących właściwości, związki domieszkowane, jak wspomniano, stanowią mniejszość wśród wielu milionów znanych (najczęściej stechiometrycznych i będących izolatorami elektryczności) substancji chemicznych. I dotychczas nie znana była żadna ogólna i prosta metoda, dzięki której można by otrzymywać układy domieszkowane. Szczególnie niepodatne na tworzenie układów domieszkowanych są wzmiankowane już super-silne utleniacze i reduktory. Problem pozostawał nierozwiązany… aż do teraz.
W opublikowanej niedawno pracy, dwóch polskich chemików z Centrum Nowych Technologii Uniwersytetu Warszawskiego, dr Adam Grzelak oraz profesor Wojciech Grochala, we współpracy z włoskim fizykiem argentyńskiego pochodzenia z Uniwersytetu La Sapienza w Rzymie oraz CNR, dr José Lorenzana, pokazało na gruncie obliczeń teoretycznych, w jaki sposób skutecznie przeprowadzić kontrolowane domieszkowanie związków chemicznych i to przy zachowaniu stechiometryczności chemicznej układu. Do zademonstrowania swojego pomysłu badacze wybrali fluorek srebra dwuwartościowego, AgF2. Jest to niezwykle reaktywny chemicznie super-utleniacz i środek fluorujący (Rys.1), używany np. w projekcie Manhattan w okresie II wojny światowej, co doprowadziło do konstrukcji pierwszej bomby atomowej. Ten ważny związek srebra był intensywnie badany przez ostatnie dwie dekady, lecz niestety dotychczas opierał się wszelkim próbom domieszkowania.

Rys.1. Przykład gwałtownej reakcji chemicznej z udziałem AgF2 (na dnie naczynia) oraz dość biernego chemicznie SiCl4 (wkraplanego kropla po kropli do naczynia; od lewej do prawej progres reakcji).
„Zaproponowaliśmy by wykorzystać nanotechnologię, a w szczególności narastanie warstw atomowych warstwa po warstwie na odpowiednim podłożu. Istotne jest przy tym, by warstwę utleniacza – AgF2 – umieścić w pewnym oddaleniu od warstwy reduktora a obie warstwy przedzielić separatorem obojętnym z punktu widzenia reakcji redoksowych (Rys.2)” – mówi prof. Wojciech Grochala, który projektował nowy układ. Całość osadzona jest na odpowiednim podłożu, zaś układ może być w dalszym stopniu zmodyfikowany poprzez osadzenie na warstwie utleniacza dodatkowej warstwy zabezpieczającej. Jako reduktor badacze zastosowali tlenek magnezu, MgO. Separacja przestrzenna reagentów jest kontrolowana w skali nano poprzez użycie konkretnej liczby warstw separatora.
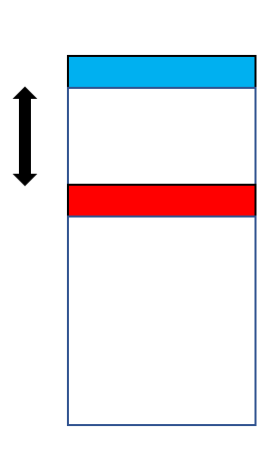
Rys.2. Ogólna konstrukcja układu do kontrolowanego wstrzykiwania ładunku do warstwy utleniacza (AgF2, kolor niebieski) z warstwy reduktora (MgO, kolor czerwony), poprzez obojętny separator o kontrolowanej grubości; całość osadzona jest na inertnym podłożu.
„Obliczenia pokazały, że gdy odległość między reagentami maleje, rośnie stopień przeniesienia ładunku między nimi, d, a zatem obie warstwy domieszkowane są w tym samym stopniu, tylko jedna elektronami, a druga dziurami” – wyjaśnia dr Adam Grzelak, który przeprowadził zaawansowane obliczenia. W każdym przypadku obserwowane jest przeniesienie niecałkowitej liczby elektronów na jednostkę stechiometryczną. Tym samym mamy do czynienia z nietypową reakcją chemiczną, która można opisać równaniem:
A + B —> (A)d+ + (B)d–
gdzie d jest zmienną liczbą niecałkowitą.
Proponowane przez badaczy warstwowe układy specjaliści przyrównują do hybrydy ogniwa elektrochemicznego (baterii) i kondensatora, nie są one jednak prostą średnią czy sumą tych urządzeń. „Rzeczywiście, działanie tego nano-urządzenia da się dobrze opisać wzorem przypominającym równanie na ładunek zgromadzony w kondensatorze, przy czy w miejsce napięcia elektrycznego występuje różnica potencjałów chemicznych reagentów, podobnie jak w równaniach opisujących działanie baterii” – dodaje dr José Lorenzana, który wyprowadził zależność.
„Cieszę się, że udało się nam zrobić coś bardzo ogólnego” – mówi prof. Grochala. „Nowy układ może zostać zastosowany do olbrzymiej gamy nieorganicznych organicznych związków chemicznych i otwiera drzwi do wielu zastosowań” – dodaje badacz.
Czas pokaże, czy proponowane przez badaczy warstwowe układy domieszkowane uda się istotnie sfabrykować w laboratorium.
Publikacja p.t.: „Separation-controlled redox reactions” ukazała się online w tygodniku Angew. Chem. Int. Ed. Engl. Badania po stronie polskiej zostały sfinansowane ze środków Narodowego Centrum Nauki w ramach projektu Maestro. Obliczenia zostały przeprowadzone na superkomputerze okeanos Interdyscyplinarnego Centrum Modelowania Matematycznego i Komputerowego UW.


