
Badania
W naszych badaniach stosujemy podejście wielowymiarowe łączące obrazowanie w różnych skalach rozdzielczości (krystalografia rentgenowska białek, fluorescencyjna mikroskopia świetlna, oraz kriotomografia elektronowa) z metodami biochemicznymi (rekonstytucje biologicznych systemów in vitro) w celu mechanistycznego zrozumienia całych komórek.
Naszym celem jest rozpoznanie pewnych aspektów biologii komórek archeonów. Archeony są uznawane za jedną z trzech głównych domen życia. Mają one wspólne cechy biologiczne zarówno z bakteriami, jak i eukariotami: system przetwarzania informacji genetycznej w archeonach jest wspólny z eukariotami, podczas gdy szlaki metaboliczne są wspólne z bakteriami. Organizmy te są fascynujące z dwóch powodów. Po pierwsze, archeony często bytują w ekstremalnych warunkach środowisk, w związku z czym interesujący dla nauki jest fakt, w jaki sposób ich ultrastruktura komórkowa, na przykład niebłonowe organelle składające się z białek zdolnych do przejść fazowych ciecz-ciecz, im to ułatwia. Po drugie, niedawno odkryto, że archeony kodują wiele białek, które do tej pory były uważane za typowo eukariotyczne, na przykład białka zaangażowane w remodelowanie membran komórkowych, biogenezę pęcherzyków i transport komórkowy. Wierzymy, że zrozumienie biologii komórki archeonów w kontekście eukariogenezy jest warunkiem wstępnym do odszyfrowania przejścia morfologicznego charakteryzującego ewolucję złożonej eukariotycznej organizacji komórkowej.
Zrozumienie tego procesu jest ważne nie tylko z punktu widzenia badań ewolucyjnych dotyczących początków życia na Ziemi, ale może również dostarczyć cennych informacji w kontekście podstawowych badań biomedycznych. Wiele białek ulegających przejściom fazowym ciecz-ciecz zawiera w swojej budowie domeny podobne do prionów, które w przypadku nieprawidłowego przejścia fazowego powodują powstanie nierozpuszczalnych włókien amyloidowych, podobnych do tych wywołujących choroby neurodegeneracyjne u ssaków. Zakładamy, że badania rozdziału faz ciecz-ciecz u archeonów, które są grupą blisko spokrewnioną z eukariotami, pozwoli na lepsze zrozumienie podstawowych zasad regulacji oraz genezy tego procesu. Stąd, wyniki naszych badań mogą dostarczyć wielu informacji istotnych dla ogólnych założeń agendy ReMedy.
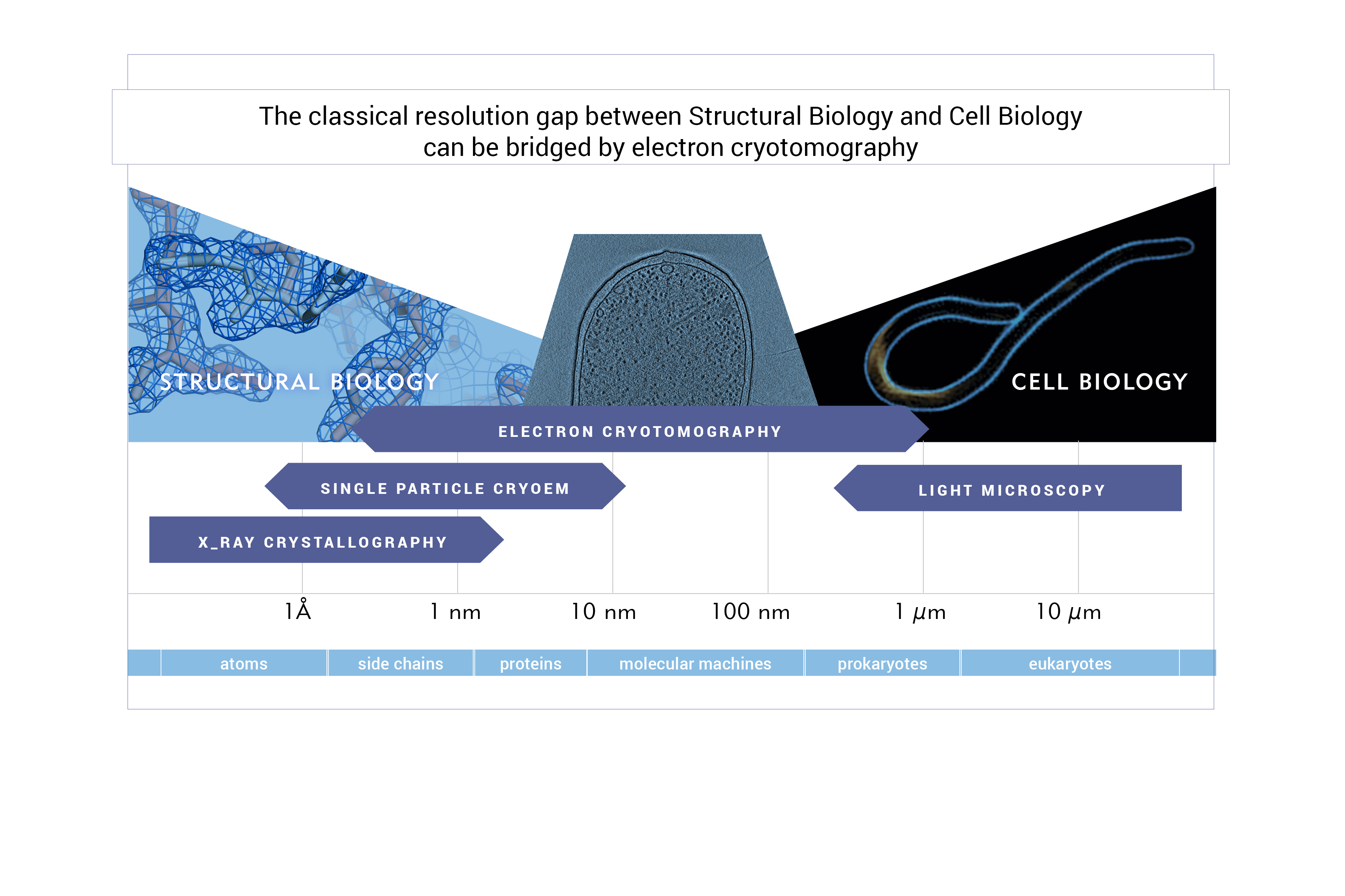
Naszą główną techniką badawczą jest kriotomografia elektronowa – technika kriomikroskopii elektronowej, która rozwiązuje unikalne struktury in situ, w stanie natywnym, w trzech wymiarach i w zakresie molekularnym, skutecznie umożliwiając badania strukturalne w nienaruszonych, zamrożonych komórkach.
W Centrum Nowych Technologii UW będziemy mieć dostęp do kriomikroskopu elektronowego 200 kV Thermo Fisher Glacios wyposażonego w bezpośredni detektor elektronów Falcon 3EC oraz płytkę fazową. Ponadto planujemy regularnie zbierać dane na kriomikroskopie elektronowym 300 kV Thermo Fisher Titan Krios G3i wyposażonym w płytkę fazową, filtr energii BioQuantum oraz bezpośrednie detektory elektronów K3 i Falcon 3EC, który będzie mieścił się w Krajowym Centrum Kriomikroskopii Elektronowej w Krakowie.
Alvarez-Malmagro, J., Jabłonowska, E., Nazaruk, E., Szwedziak, P., & Bilewicz, R.
Bioelectrochemistry, 134(107516)
Alvarez-Malmagro, J., Matyszewska, D., Nazaruk, E., Szwedziak, P., & Bilewicz, R. (2019).
Langmuir, 35(50), 16650-16660.
| Tytuł | Termin nadsyłania aplikacji |
|---|---|
| Postdoc in ReMedy (Laboratory of Structural Cell Biology) | 15/12/2019 |
| ReMedy – Postdoc in Laboratory of Structural Cell Biology | 10/08/2019 |
| Public Procurement and Financial Specialist | 30/07/2019 |
| Grant Office Specialist | 30/07/2019 |
| Lab Organization Specialist/Manager | 19/07/2019 |
| PhD Student at ReMedy | 30/04/2019 |



